●凡本网注明“来源:仪器批发网”的所有作品,版权均属于仪器批发网,转载请必须注明仪器批发网,http://www.china17pf.com/,违反者本网将追究相关法律责任。
●本网转载并注明自其它来源的作品,目的在于传递更多信息,并不代表本网赞同其观点或证实其内容的真实性,不承担此类作品侵权行为的直接责任及连带责任。其他媒体、网站或个人从本网转载时,必须保留本网注明的作品来源,并自负版权等法律责任。
●如涉及作品内容、版权等问题,请在作品发表之日起一周内与本网联系,否则视为放弃相关权利。
PCR技术,即聚合酶链反应(polymerase chain reaction,PCR)是由美国PE Cetus公司的Kary Mullis在1983年(1993年获诺贝尔化学奖)建立的。这项技术可在试管内的经数小时反应就将特定的DNA片段扩增数百万倍,这种迅速获取大量单一核酸片段的技术在分子生物学研究中具有举足轻重的意义,极大地推动了生命科学的研究进展。
关键词:PCRPCR聚合酶链反应
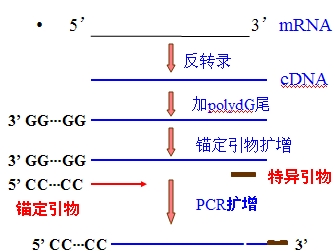
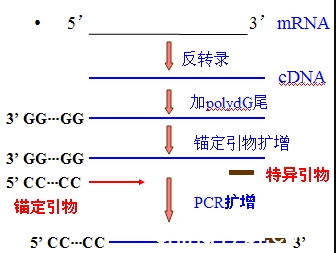
一.锚定PCR(anchored PCR):
引进锚定引物,可以帮助克服序列未知或序列未全知的障碍。
在DNA3’-末端加上poly(dG)尾,与此相对应的锚定引物poly(dC)一般应在十二聚以上。
二.不对称PCR(asymmetric PCR)
不对称PCR主要是在PCR体系中设计不同的引物浓度,两条引物浓度比为1:50或1:100,前12个循环两条模板等量扩增,之后低浓度引物消耗殆尽,其扩增产物减少以至于无;而高浓度引物介导产生的扩增产物(即单链DNA)逐渐增加,可得到大量单链DNA(ssDNA)用于直接测序。
三.反向PCR(inverse PCR)
四.多重PCR(multiplex PCR)
多重PCR是用多对引物同时对模板DNA上的多个区域进行扩增。
多重PCR技术的难点不是在于其原理和操作的复杂性,而是在于其多对引物的设计,必需保证多对引物之间不形成引物二聚体,引物与目标模板区域具有高度特异性。
应用于基因诊断,对与疾病相关的基因(庞大)进行扩增检测。
五.逆转录PCR(reverse transcription PCR,RT-PCR)
由mRNA逆转录产生cDNA链作为PCR反应模板。
逆转录合成cDNA时,引物可选用特异引物、随机六聚体引物或寡聚dT(12-18)。
设计RT-PCR的引物时最好是分散在不同的外显子上,以免基因组DNA的污染导致假阳性结果
一、实验目的
1.掌握聚合酶链式反应的原理。
2. 掌握移液枪和PCR仪的基本操作技术。
二、实验原理
PCR技术,即聚合酶链反应(polymerase chain reaction,PCR)是由美国PE Cetus公司的Kary Mullis在1983年(1993年获诺贝尔化学奖)建立的。这项技术可在试管内的经数小时反应就将特定的DNA片段扩增数百万倍,这种迅速获取大量单一核酸片段的技术在分子生物学研究中具有举足轻重的意义,极大地推动了生命科学的研究进展。它不仅是DNA分析最常用的技术,而且在DNA重组与表达、基因结构分析和功能检测中具有重要的应用价值。
PCR可以被认为是与发生在细胞内的DNA复制过程相似的技术,其结果都是以原来的DNA为模板产生新的互补DNA片段。细胞中DNA的复制是一个非常复杂的过程。参与复制的有多种因素。PCR是在试管中进行的DNA复制反应,基本原理与细胞内DNA复制相似,但反应体系相对较简单。
PCR由变性--退火--延伸三个基本反应步骤构成:①模板DNA的变性:模板DNA经加热至94℃左右一定时间后,使模板DNA双链或经PCR扩增形成的双链DNA解离,使之成为单链,以便它与引物结合,为下轮反应做准备;
②模板DNA与引物的退火(复性):模板DNA经加热变性成单链后,温度降至55℃左右,引物与模板DNA单链的互补序列配对结合;
③引物的延伸:DNA模板--引物结合物在Taq酶的作用下,以dNTP为反应原料,靶序列为模板,按碱基配对与半保留复制原理,合成一条新的与模板DNA 链互补的半保留复制链。
重复循环变性--退火--延伸三过程,就可获得更多的“半保留复制链”,而且这种新链又可成为下次循环的模板。每完成一个循环需2~4分钟, 2~3小时就能将待扩目的基因扩增放大几百万倍。
三、实验试剂与器材
模板DNA、2.5mmol/L dNTP
Taq DNA聚合酶(5U/μL)、SSR引物
10 ×buffer、15mmol/L Mg2+、ddH2O
PCR仪、移液枪、PCR板
四、实验步骤
一、实验器具与材料:
1、移液枪:1ml、200μl、20μl、10μl、2μl
2、吸头:1ml、200μl、20μl
3、匀浆管:5ml
4、吸头台:放置1ml吸头的一个,放置20μl吸头的一个
5、EP管:1.5ml、0.2ml、100μl
6、试剂瓶:2个60ml的棕色试剂瓶(广口,带盖)
1个125ml的白色试剂瓶(放无水乙醇)
7、量筒:50ml、250ml、500ml
8、容量瓶:250ml、500ml、1000ml
9、试管架:5ml、1.5ml、20μl
10、盐水瓶:250ml、500ml各2个备用,一个装无水乙醇,另一个装DEPC水
11、铝制饭盒:4个
12、塑料小饭盒:1个
13、大瓷缸:2个
14、锡泊纸:一卷
15、卷纸:2卷
16、三角烧瓶:带盖,稍大
二、实验器具的处理与准备
1、塑料制品:(包括枪头、EP管、匀浆管等)
先将DEPC水从容量瓶中倒入瓷缸中,将塑料制品逐个浸泡其中,其中小枪头需要吸管打入DEPC水,过夜,然后高压,再烤干备用,实验前将枪头等放入吸头台,再高压一次(EP管)
2、玻璃制品:泡酸过夜,冲洗干净,蒙锡纸烤干备用(DEPC水泡)(洗净后先泡1‰DEPC过夜,再烤干)
3、匀浆器:(包括剪刀、镊子)先洗净后,再高压(不需要泡DEPC)
三、试剂配制:
1、DEPC水:吸出1ml放在1000ml双蒸水中配成1‰DEPC水,放在1000ml容量瓶中静置4小时备用。
2、75%乙醇:用无水乙醇 DEPC水配,然后放-20℃保存(其中DEPC水需先高压)
3、异丙醇:放入棕色瓶中
4、nvfang:放入棕色瓶中
5、琼脂糖
四、几种缓冲液的配制:
1、电泳缓冲液:
Tris 54g
硼酸 27.5g
0.5M EDTA 20ml? pH8.0
蒸溜水 1000ml
5×TBE (贮存液)
再将5×TBE稀释10倍成0.5TBE就可以在电泳时使用(即工作液浓度),如取50ml贮存液 450ml水--→500ml工作缓冲液
2、上样缓冲液:
0.25%溴酚蓝
0.25%二甲苯青FF
30%甘油
6×缓冲液,4℃保存
五、琼脂糖凝胶的配制:
1、1.0%:
1.0g琼脂糖 100ml电泳缓冲液,微波炉中火30秒至沸腾,熔化的琼脂物冷却至60℃时加入10mg/ml溴化乙锭2.5μl,充分混匀,将温热的凝胶倒入已置好梳子的胶膜中,在室温下放置30-45min后现进行电泳。
2、1.5%:
同上,将琼脂糖的量改为1.5g
六、需购置的RT-PCR材料:
(生工. Tel. 2236106.)
Taq酶(含MgCl2 Buffer) 200u 70.00
dNTP: 1支
Oligo(dT)15: 1 OD 40.00 promega
M-MLV: 1支 250.00 promega (Buffer)
RNasin: 1支 110
-- -20℃
DEPC 5g 110.00
Trizol 100ml/1瓶 Invitrogen Life technologies
-- 4℃
Marker: 10μg 0.2μg/ml 150.00 科威
(1543. 994. 697. 515. 377. 231)
七、引物合成
正义:5′-CACGATGGAGGGGCCGGACTCATC-3′
反义:5′-TAAAGACCTCTATGCCAACACAGT-3′
2、par-4:
正义:5′-GGGACCTCGGAACTCAAC-3′
反义:5′-TGTATCTGCCTGGGACTG-3′
3、退火温度计算
2(A T) 4(G C)
正反义平均数,再上下波动度(±4℃,或±5℃)
4、引物各合成5 OD,每OD一瓶分装好
5、引物稀释:
加DEPC水量为(μl)
= nmol / OD × 管上所标OD数×100
是为10p mol / μl 浓度的引物溶液
八、PCR产物电泳
先将1-10μl左右PCR产物,加已点在纸上的溴酸兰,反复吸打混匀后进行电泳,一般电流为10mA,电源100V,电泳30分钟,紫外灯下观察,满意的结果扫描打印。
九、几个注意点:
1、逆转录的关键步骤是立即冰水浴?
2、Rt时,先打开PCR预热30分钟。
3、RNA抽提前,打开离心机预冷。
TRIzol法抽提总RNA
细胞1×107
组织100mg
↓
加1mlTRIzol
细胞用1ml加样器吹至液体澄清且无细胞团块
↓
匀浆(要彻底,后转至EP管)
(组织匀浆量>100mg时分装1ml/每EP管)
↓
颠倒混匀10下,室温5分钟
↓
加nvfang1/5体积(0.2ml)(必须按总体积的1/5)
颠倒混匀10下,室温5分钟
↓
4℃,离心12000g,15分钟
↓
转上层水相(约400μl)于另一1.5mlEP管中
↓
加等体积异丙醇(约400μl),混匀室温10分钟
↓
4℃,离心12000g,10分钟
↓
弃上清
↓
加冰预冷的75%乙醇(用DEPC水配)1ml
↓
4℃离心7500g,5分钟
↓
弃上清,空气干燥5-10分钟(不能完全干燥)
↓
溶于DEPC水中至20μl(10μl-20μl)
(可在55-60℃水中,<10分钟助溶)
注:
1、RNA若用于核酸转移应溶解于样本缓冲液中,否则DEPC溶解
2、细胞组织加TRIzol匀浆后,可在-60℃放置至少一个月(甚至可一年以上)
3、RNA在75%乙醇中,2-8℃至少可保存一周,-20℃至少可保存一年
两步法RT-PCR
(第一步:逆转录反应)
试剂 浓度 体积 终浓度
RNA 23μl(11.5μl)
Oligo(dT)15 0.05μg/μl 4μl(2μl) 0.005μg/μl
(稀释10倍后用)
↓
混匀,离心,70℃ 5min
↓
立即冰水浴,稍离心
↓
试剂 浓度 体积 终浓度
M-MLV Buffer 5× 8μl (4μl) 1×
dNTP 10mM 2μl (1μl) 0.5mM
RNasin 40U/μl 1μl (0.5μl) 20μ
M-MLV 200U/μl 2μl (1μl) 200U
总体积40μl(20μl)
↓
混匀,离心,42℃ 60min
↓
95℃ 10min(破坏MLV)
↓
4℃保存
两步法RT-PCR
(第二步:PCR反应)
总体积20μl(50μl)
试剂 浓度 体积 终浓度
Taq Buffer 10× 2μl (5μl_) 1×
MgCl2 25mM 1.2μl (3μl) 1.5mM
dNTP 10mM 0.2μl (0.5μl) <200uM
上游引物 10pmol/μl 0.3μl (1μl) 10pmol
下游引物 10pmol/μl 0.3μl (1μl) 10pmol
cDNA模板 X (?) (1-10μl)
DEPC水 20μl-4.3μl-X

●凡本网注明“来源:仪器批发网”的所有作品,版权均属于仪器批发网,转载请必须注明仪器批发网,http://www.china17pf.com/,违反者本网将追究相关法律责任。
●本网转载并注明自其它来源的作品,目的在于传递更多信息,并不代表本网赞同其观点或证实其内容的真实性,不承担此类作品侵权行为的直接责任及连带责任。其他媒体、网站或个人从本网转载时,必须保留本网注明的作品来源,并自负版权等法律责任。
●如涉及作品内容、版权等问题,请在作品发表之日起一周内与本网联系,否则视为放弃相关权利。