●凡本网注明“来源:仪器批发网”的所有作品,版权均属于仪器批发网,转载请必须注明仪器批发网,http://www.china17pf.com/,违反者本网将追究相关法律责任。
●本网转载并注明自其它来源的作品,目的在于传递更多信息,并不代表本网赞同其观点或证实其内容的真实性,不承担此类作品侵权行为的直接责任及连带责任。其他媒体、网站或个人从本网转载时,必须保留本网注明的作品来源,并自负版权等法律责任。
●如涉及作品内容、版权等问题,请在作品发表之日起一周内与本网联系,否则视为放弃相关权利。
涉及品种范围包括获得有效国内医疗器械注册(备案)证的新型冠状病毒(2019-nCoV)核酸、IgM抗体、IgG抗体、IgM/IgG抗体、总抗体、抗原检测试剂盒,以及新型冠状病毒检测配套的核酸提取或纯化试剂类、样本采集器具类、疫苗接种注射器类医用耗材。
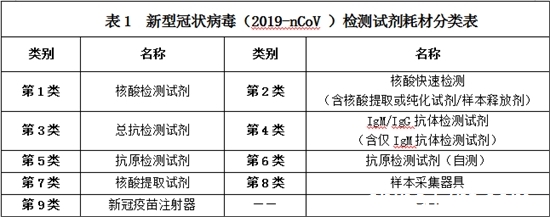
一、第1类核酸检测试剂
取得国家医疗器械注册证的新型冠状病毒(2019-nCoV)核酸检测试剂盒。
二、第2类核酸快速检测(含核酸提取或纯化试剂)
取得国家医疗器械注册证的新型冠状病毒(2019-nCoV)核酸检测试剂盒/核酸提取或纯化试剂;且“核酸提取、扩增检测均在同一封闭、便携式仪器上完成;样本上机后至结果报告过程,无需任何手工操作,且全流程时间不超过90分钟。”(国家卫生健康委临床检验中心【卫检中字〔2020〕第15号】)
第2类核酸快速检测按新型冠状病毒(2019-nCoV)核酸检测试剂和核酸提取或纯化试剂进行组套申报。若核酸快速检测无需另外配套核酸提取或纯化试剂,则仅按新型冠状病毒(2019-nCoV)核酸检测试剂盒进行申报。
三、第3类总抗检测试剂
取得国家医疗器械注册证的新型冠状病毒(2019-nCoV)抗体检测试剂盒。
四、第4类IgM/IgG抗体检测试剂(含仅IgM抗体检测试剂)
取得国家医疗器械注册证的新型冠状病毒(2019-nCoV)IgM/IgG 抗体检测试剂盒,或取得国家医疗器械注册证的新型冠状病毒(2019-nCoV)IgM 或 IgG 抗体检测试剂盒。
第4类中同一企业同时取得新型冠状病毒(2019-nCoV)IgM抗体检测试剂盒注册证和新型冠状病毒(2019-nCoV)IgG抗体检测试剂注册证的,按新型冠状病毒(2019-nCoV)IgM/IgG抗体检测试剂进行申报。
五、第5类抗原检测试剂
取得国家医疗器械注册证的新型冠状病毒(2019-nCoV)抗原检测试剂盒。
六、第6类抗原检测试剂(自测)
取得国家医疗器械注册证的新型冠状病毒(2019-nCoV)抗原检测试剂盒,并符合国务院应对新型冠状病毒肺炎疫情联防联控机制综合组《关于印发新冠病毒抗原检测应用方案(试行)的通知》(联防联控机制综发〔2022〕21号)要求可在零售药店销售的抗原检测类试剂。
七、第7类核酸提取试剂
获得有效国内医疗器械注册(备案)证的核酸提取试剂。适用于新型冠状病毒(2019-nCoV)核酸配套检测,指主要用于核酸的提取、富集、纯化等步骤,其处理后的产物用于临床体外检测使用。本次采购的核酸提取或纯化试剂仅指用于机器使用的产品,包含专机专用和非专机专用产品。
八、第8类样本采集器具
获得有效国内医疗器械注册(备案)证的样本采集器具。使用于新型冠状病毒(2019-nCoV)样本的采样收集与保存,主要由拭子和含保存液的杯、管等组成,保存液包含灭活型和非灭活型产品。样本采集器具申报时须同时申报保存液和拭子(两者可为不同品牌,由保存液生产企业进行申报),保存液的容量需包含大于或等于3ml的规格;若申报时仅申报保存液或拭子其中一种的品种,不属于本次报名范围。
九、第9类新冠疫苗注射器
指获得有效国内医疗器械注册证的一次性使用无菌注射器类医用耗材;产品质量需符合GB15810-2019、GB15811-2016和GB∕T18457-2015,并通过ISO13485认证或CE认证。产品范围如下:容量1ml,标识的最大刻度1ml,最小刻度0.1ml,针头0.5×16RW LB或0.45×16RW LB;容量2ml,标识的最大刻度2ml,最小刻度0.1ml,针头0.5×16 RW LB。

●凡本网注明“来源:仪器批发网”的所有作品,版权均属于仪器批发网,转载请必须注明仪器批发网,http://www.china17pf.com/,违反者本网将追究相关法律责任。
●本网转载并注明自其它来源的作品,目的在于传递更多信息,并不代表本网赞同其观点或证实其内容的真实性,不承担此类作品侵权行为的直接责任及连带责任。其他媒体、网站或个人从本网转载时,必须保留本网注明的作品来源,并自负版权等法律责任。
●如涉及作品内容、版权等问题,请在作品发表之日起一周内与本网联系,否则视为放弃相关权利。